Cấu hình electron nguyên tử

I. THỨ TỰ CÁC MỨC NĂNG LƯỢNG TRONG NGUYÊN TỬ
1. Nguyên lí vững bền:
- Các electron nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao.
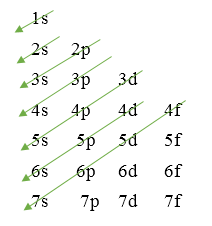
- Thứ tự sắp xếp mức năng lượng (phân mức năng lượng) theo chiều mũi tên:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
- Thứ tự các lớp electron: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f …
2. Nguyên lí Pauli
- Trên 1 obitan nguyên tử chứa tối đa 2 electron và có chiều tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
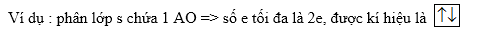
3. Quy tắc Hund
- Trong cùng 1 phân lớp, các electron điền vào các obitan sao cho số electron độc thân là lớn nhất.
Ví dụ:
+ Có 3e phân bố trong 3AO của phân lớp p như sau:
$\uparrow $ | $\uparrow $ | $\uparrow $ |
+ Có 5e phân bố trong 3 AO của phân lớp p như sau:
$\uparrow \downarrow $ | $\uparrow \downarrow $ | $\uparrow $ |
+ Có 5e phân bố trong 5 AO của phân lớp d như sau:
$\uparrow $ | $\uparrow $ | $\uparrow $ | $\uparrow $ | $\uparrow $ |
II. CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
1. Cấu hình electron của nguyên tử
- Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
- Quy ước các viết cấu hình e:
+ STT lớp e được ghi bằng chữ số (1, 2, 3, …)
+ Phân lớp được ghi bằng các chữ cái thường s, p, d, f
+ Số e được ghi bằng số ở phía trên bên phải của phân lớp (s2, p6)
- Một số chú ý khi viết cấu hình e:
+ Cần xác định đúng số e của nguyên tử hay ion (số e = số p = Z)
+ Nắm vững các nguyên lí và quy tắc, kí hiệu của lớp và phân lớp
+ Quy tắc bão hòa và bán bão hòa trên d và f: Cấu hình e bền khi các e điền vào phân lớp d và f đạt bão hòa (d10, f14) hoặc bán bão hòa (d5, f7)
- Các bước viết cấu hình e nguyên tử
B1: Điền lần lượt các e vào các phân lớp theo thứ tự tăng dần mức năng lượng.
B2: Sắp xếp lại theo thứ tự các lớp và phân lớp theo nguyên tắc từ trong ra ngoài.
B3: Xem xét phân lớp nào có khả năng đạt đến bão hòa hoặc bán bão hòa thì có sự sắp xếp lại các electron ở các phân lớp (chủ yếu là d và f)
Ví dụ: Viết cấu hình e nguyên tử của các nguyên tố sau:
+ H (Z = 1) : 1s1
+ Ne (Z = 10) : 1s22s22p6
+ Cl (Z = 17) : 1s22s22p63s23p5
Chú ý trường hợp đặc biệt: Các nguyên tố có cấu hình nguyên tử bán bão hòa:
Cr (Z = 24) 1s22s22p63s23p63d44s2 chuyển thành 1s22s22p63s23p63d54s1
Cu (Z = 29) 1s22s22p63s23p63d94s2 chuyển thành 1s22s22p63s23p63d104s1
- Cách xác định nguyên tố s, p, d, f:
+ Nguyên tố s: có electron cuối cùng điền vào phân lớp s
+ Nguyên tố p: có electron cuối cùng điền vào phân lớp p
+ Nguyên tố d: có electron cuối cùng điền vào phân lớp d
+ Nguyên tố f: có electron cuối cùng điền vào phân lớp f
2. Cấu hình e nguyên tử của 20 nguyên tố đầu (sgk)
3. Đặc điểm của lớp e ngoài cùng
- Đối với tất cả các nguyên tố, lớp ngoài cùng có nhiều nhất là 8 electron (không tham gia vào các phản ứng hóa học)
- Khí hiếm (Trừ He có 2e lớp ngoài cùng) có 8e lớp ngoài cùng
- Kim loại: 1, 2, 3 e lớp ngoài cùng
- Phi kim : 5, 6, 7 e lớp ngoài cùng
- Nguyên tử có 4 electron ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
Tổng ôn tập MÔN HÓA Lớp 10