Phương pháp giải bài tập phản ứng nhiệt nhôm không hoàn toàn

Phản ứng nhiệt nhôm tổng quát:
Al + oxit kim loại → oxit nhôm + kim loại
(hỗn hợp X) (hỗn hợp Y)
2yAl + 3MxOy $\xrightarrow{{{t}^{o}}}$ yAl2O3 + 3xM (M là các kim loại trung bình như Fe, Cu, Cr,…)
Phản ứng không hoàn toàn (H < 100%)
Ví dụ: 2Al + Fe2O3 $\xrightarrow{{{t}^{o}}}$ Al2O3 + 3Fe
=> hỗn hợp Y gồm Al2O3, Fe, Al dư và Fe2O3 dư
- Tính H phản ứng nhiệt nhôm, tính theo chất có tỉ lệ nhỏ hơn ($\frac{{{n}_{Al\text{ }bđ}}}{2}$ so với $\frac{{{n}_{F{{e}_{2}}{{O}_{3}}}}}{1}$)
- Bảo toàn khối lượng: mhhX = mhhY
- Bảo toàn nguyên tố: ${{n}_{Al\text{ }(X)}}~=\text{ }{{n}_{Al\text{ }(Y)}}~;\text{ }{{n}_{Fe\text{ }(X)}}~=\text{ }{{n}_{Fe\text{ }(Y)}}~;\text{ }{{n}_{O\text{ }(X)}}~=\text{ }{{n}_{O\text{ }(Y)}}$
- Bảo toàn electron:
+ Cho Al dư tác dụng với dung dịch NaOH sinh ra H2: 3.nAl dư = 2.nH2
+ Hỗn hợp sau phản ứng (Al dư, Fe, oxit ) tác dụng với H+ : 3.nAl dư + 2.nFe = 2.nH2
+ Hh sau phản ứng gồm kim loại và oxit kim loại
2H+ + O2- $\to $ H2O
2H+ + 2e $\to $ H2
=> ${{n}_{{{H}^{+}}}}$ pứ $=\text{ }2.{{n}_{O\text{ }(trong\text{ }oxit)}}+\text{ }2.{{n}_{{{H}_{2}}}}$
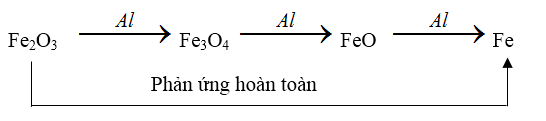
+ Với oxit của kim loại hóa trị nhiều hóa trị : quá trình nhiệt nhôm xảy ra theo từng nấc
Tổng ôn tập MÔN HÓA Lớp 12